Определение мутаций онкогена KRAS при колоректальном раке
Колоректальный рак (КРР) - одна из наиболее распространенных опухолей в мире и вторая по частоте причина смерти от рака в Европе. В то время как оперативное вмешательство является основным лечением КРР на ранней стадии, химиотерапия все-таки остается для метастатического рака терапией первой линии, когда хирургическим путем удалить опухоль невозможно.
За последние тридцать лет наблюдается тенденция к снижению смертности от КРР, однако отмечается разная выживаемость. Объяснить это можно существенными различиями в характеристиках опухоли и пациента, стратегиями терапии и прочими факторами, которые влияют на клинический ответ.
Ведение таких пациентов с метастатическим раком предполагает разработку определенной терапевтической стратегии, включающей, как правило, несколько линий терапии, оперативные симптоматические вмешательства, периоды, свободные от терапии, поддерживающее лечение. Индивидуализация терапии базируется на оценке факторов выживаемости (уровня лактадегидрогеназы, общей оценки состояния) и предикторных факторов (мутации гена KRAS).
Белок KRAS - это ГТФаза и одна из ключевых молекул в нисходящем сигнальном пути рецептора человеческого эпидермального фактора роста (EGFR). Белок KRAS преобразовывает сигналы от связанных с мембраной рецепторов через множество нисходящий эффекторных путей, влияя, таким образом, на фундаментальные клеточные процессы, включая пролиферацию, апоптоз и дифференциацию. Обнаружено, что в тканях некоторых злокачественных опухолей белок KRAS находится в состоянии постоянной активности вследствие соматических мутаций.
Большинство мутаций, приводящих к активации KRAS находятся в экзонах 12 и 13. Кроме того, в ряде опухолей, встречающихся у человека (колоректальный рак, рак поджелудочной железы, легких), обнаружены точечные мутации гена KRAS.
Мутационный статус гена KRAS коррелирует с первичной лекарственной резистентностью колоректального и немелкоклеточного рака легких при лечении ингибиторами тирозинкиназы. У пациентов с геном KRAS дикого типа может быть эффективным применение Эрбитукса (Цетуксимаб) или Вектибикса (Панитумумаб), тогда как у пациентов с мутантным геном KRAS наблюдается слабый ответ на лечение.
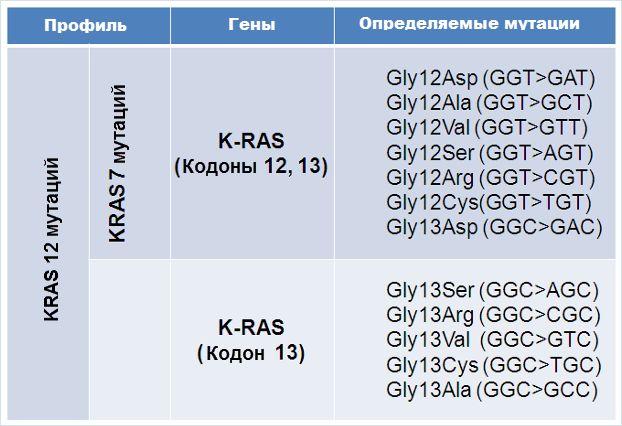
Варианты тестирования: Тестирование KRAS возможно в нескольких конфигурациях. Панель KRAS-7 позволяет определить 7 клинически значимых мутаций гена KRAS в кодонах 12 и 13. Панель KRAS-12 позволяет дополнительно определить 5 редких мутаций в кодоне 13.

Анализ 7 мутаций гена KRAS в опухоли
Что такое ген KRAS?
KRAS - онкоген, кодирующий один из белков, которые играют важнейшую роль в системе рецептора эпидермального фактора роста (РЭФР) - сложнейшего сигнального каскада, принимающего непосредственно участие в прогрессировании КРР. Этот ген был назван в честь Werner H.Kirsten – доктора, руководителя отдела патологии в медицинском центре в Чикаго. Впервые он описал этот ген при саркомах крыс. Белок KRAS регулирует белки, которые находятся в сигнальной системе РЭФР, связанные с выживаемостью опухоли, пролиферацией, ангиогенезом и метастазированием. Этот белок считается ключевым компонентом системы РЭФР, так как именно он передает сигналы с РЭФР к механизму транскрипции в ядре.
Обычно гены-супрессоры и онкогены KRAS работают вместе, регулируя нормальное деление клеток. Если онкогены KRAS отвечают за включение процесса роста клеток, то гены-супрессоры - за выключение этих процессов. Но когда онкоген подвергается мутации, он провоцирует быстрое деление клеток, приводящее к образованию опухоли. Если же результат мутации гена-супрессора сравним с поломкой тормоза в машине, то мутацию онкогена сравнивают с педалью газа, вжатой в пол. Он заставляет делиться клетки без конца, и процесс деления все ускоряется и ускоряется.
Типы гена KRAS
Находят в опухолях три типа онкогена KRAS. Кодируют или мутированный белок (аномальный), известный как мутантный тип KRAS, или немутированный белок («нормальный»), известный как дикий тип. Такой «статус» белка KRAS указывает на прогноз и несет предиктивную информацию в отношении ответа на применение анти-РЭФР терапии.
В опухолях с диким типом система РЭФР функционирует нормально, и активируется белок KRAS только на некоторое время в ответ на стимуляцию, такую как активацию сигнальной системы РЭФР. В свою очередь в опухолях с мутированным геном белок KRAS находится постоянно во «включенном» состоянии независимо от активации системы РЭФР. В результате этого эффекты, которые ведут к росту опухоли и ее дальнейшему распространению, не регулируются.
При КРР около 60% пациентов имеют дикий тип онкогена KRAS и нормальную систему РЭФР, остальные же 40% - мутантный тип онкогена. Как правило, (в 90% случаях) мутация KRAS происходит в 12 и 13 генных кодонах, кодирующих остатки домена белка KRAS, который связывает гуанин нуклеотид. Такая мутация стабилизирует в активном состоянии KRAS, в соединении с ГТФ, благодаря снижению активности собственной ГТФ активности белка. Гораздо реже описываются мутации в следующих кодонах: 146, 63, 61 и 59.
KRAS - представитель семейства RAS, мелких белков, которые связывают гуанозиновые нуклеотиды. К ним также относятся NRAS и НRAS. Указанные белки крепятся к цитоплазматической стороне мембраны с помощью липидных остатков на С-терминальной части. Ген KRAS является молекулярным переключателем, следовательно, как и для других белков RAS, основная функция KRAS заключается в самом переходе из неактивного ГДФ состояния в активное, в котором белок высвобождает ГДФ, связывая при этом ГТФ в той же зоне. Включение или активация KRAS наступает после димеризации РЭФР и прикрепления ЭФР к РЭФР, что приводит к аутофосфорилированию и синтезу целого ряда адаптивных белков и продуктов обмена гуанина. Затем активированный KRAS через ряд сложнейших внутриклеточных каскадов, включающих систему RAF-1-MEK-MAPK, передает сигналы роста. В физиологическом нормальном сигнальном процессе KRAS выключается самостоятельно благодаря ГТФ-азе, которая гидролизирует связанный ГТФ до ГДФ, тем самым возвращая белок в неактивное состояние.
Практически все злокачественные опухоли развиваются из-за мутации онкогена KRAS. Внешние факторы не вызывают образование КРР, а лишь запускают мутации, приводящие к его появлению. Говоря иными словами, если ген KRAS можно сравнить с обычной лампочкой, которую вы можете включить, а внешние факторы – ни что иное, как выключатель, при нажатии на который включаются этот ген. Но даже в случае, если вы вдруг унаследовали «плохие» гены, можно уменьшить риск заболевания, ведя здоровый образ жизни и регулярно проходя обследование. Таким образом, нужно понимать ваши факторы риска КРР – те условия, которые понижают или повышают вероятность заболевания.
Анализ мутаций онкогена KRAS
Анализ KRAS показывает, является ли он нормальным, или в его структуре имеются генетические отклонения. Этот анализ выполняется в генетической лаборатории. Для его проведения нужен образец ткани, получаемый при помощи биопсии.
Трактовка результатов анализа KRAS
- генетически нормальный профиль KRAS является основным показанием для проведения лечения, подавляющего гиперактивность РЭФР.
- мутации (изменения) KRAS свидетельствуют о невозможности лечения.
Что дает проверка на этот онкоген?
Биологическое лечение - высокоэффективный метод, способный на раннем этапе развития опухоли привести к полному и быстрому выздоровлению больного. Но применение данного метода обусловлено целым рядом генетических факторов.
Важно! Такая проверка на онкоген KRAS дает возможность точно и быстро выбрать оптимальный способ лечения. Во-первых, она дает возможность не тратить время (столь драгоценное для больного) на попытки неадекватного лечения. Во-вторых, будучи применено правильно, такое лечение позволяет избежать травматичных для организма способов лечения: химиотерапии и хирургии с их тяжелыми побочными явлениями. Таким образом, анализ является одним из современных, передовых методов выбора тактики лечения колоректального рака.
Какие методы применяются в лабораториях для KRAS теста?
В лабораториях разработан тест на мутации 13 и 12 кодонов KRAS в режиме реального времени в формате ПЦР. Чувствительность этого теста позволяет определить наличие 5% мутантной ДНК в опухоли, что гораздо выше чувствительности секвенирования ДНК. Для генетического исследования применяется биопсийный или операционный материал, а также «архивные блоки», то есть залитые в парафин ткани.
В качестве источника ткани может использоваться как метастаз, так и первичное новообразование. Время забора биопсийного материала не имеет значения: операционный материал, который взят на этапе диагностики, биопсийный материал и ткань, полученные из метастазов, пригодны для анализа.
Допустимо запрашивать из специального патоморфологического архива лекарственные препараты, произведенные несколько лет назад.
Материалом для определения мутаций в гене KRAS может быть:
- свежезамороженная опухолевая ткань;
- блок ткани опухоли, который фиксирован формалином и заключен в парафин;
- срезы в парафине опухолевой ткани.
Содержание опухолевых клеток:
Для корректного анализа мутаций онкогена KRAS ткань должна содержать более 10% опухолевых клеток. Так как для определения отсутствия или наличия мутации онкогена KRAS важно выделить врачом достаточное количество ДНК, одним из основных критериев пригодности материала считается большое содержание клеток опухоли.
Для того чтобы результаты теста адекватно отражали отсутствие/наличие в опухоли генетических изменений содержание в препарате опухолевых клеток должно быть:
- минимально – 20%;
- оптимально - 50%;
- в других случаях следует провести микро- или макродиссекцию (изоляцию отдельных клеток с нужными характеристиками).
Наличие специального гистологического препарата, который получен из среза опухоли в комплекте с «парафиновым блоком» значительно упрощает процедуру выделения клеток для генетического анализа.
Условия фиксации ткани.
Еще один фактор, который оказывает решающее влияние на достоверность и точность результата исследования - это, конечно же, условия обработки, которую претерпел материал перед тем, как из него выделили ДНК. Фиксация ткани формалином - процедура, обеспечивающая сохранность биологического материала, хотя, взаимодействуя с нуклеиновыми кислотами (РНК, ДНК), формалин стимулирует их разрушение, делая их непригодными для генетических манипуляций.
Препараты-ингибиторы рецептора эпидермального ростового фактора
Последние достижения в понимании механизмов образования злокачественных опухолей способствовали разработке более эффективных препаратов и методов лечения КРР. Теперь стало совершенно понятно, что опухоли, возникающие в одном и том же внутреннем органе, могут быть разными на молекулярно-генетическом уровне. Выявление таких особенностей каждой опухоли является ключом к верному лечению.
Применяемая система анализа ДНК для определения мутаций KRAS, BRAF, РЭФР позволяет выявить 1% мутантных онкогенов при 99% совершенно нормальной ДНК. Основана эта технология на применении зондов в режиме реального времени в формате ПЦР. Метод помогает врачам в выявлении опухолей, которые содержат мутантные гены, для выбора правильного лекарственного препарата для лечения.
На сегодняшний день существует два типа препаратов - ингибиторов рецепторов эпидермального ростового фактора, применяющихся в таргетной терапии опухолей:
- анти-РЭФР антитела (Вектибикс и Эрбитукс);
- ингибиторы ТК РЭФР (препараты Тарцева и Иресса).
Эффективность лечения данным препаратами зависит от наличия мутаций в KRAS, статуса РЭФР и прочих факторов.
При отсутствии мутации в онкогене KRAS эффективность лечения КРР очень высока. В случае же наличия мутаций в онкогене KRAS в опухолевых клетках больного, использование Вектибикса или Эрбитукса не приводит к позитивным результатам. В 30-40% случаях выявляются мутации 13 или 12 кодонов KRAS, коррелирующих с резистентностью опухолей к лечению препаратами Вектибиксом или Эрбитуксом. В связи с этим Европейское Медицинское Агентство и Американское Общество Онкологов рекомендует использование препаратов Вектибикс и Эрбитукс только для лечения опухолей, которые содержащих онкоген KRAS дикого типа (то есть без мутаций).
Результаты многочисленных исследований подтвердили клиническую эффективность вышеперечисленных препаратов:
- препараты - ингибиторы РЭФР улучшают эффективность лечения мутантного КРР в сочетании с существующими на сегодняшний день схемами медикаментозной терапии данной патологии; для пациентов с метастатическим поражением органов данное утверждение имеет большое значение в плане возможности хирургического вмешательства и улучшения прогноза;
- препараты - ингибиторы РЭФР открывает большие перспективы для большинства больных мутантным КРР в плане получения длительной стабилизации опухолевого процесса;
- хорошая переносимость препаратов и возможность контроля их побочных эффектов (кожных реакций и диареи) доказаны в многочисленных клинических исследованиях;
- прогностическим фактором эффективности препаратов являются именно онкоген KRAS и некоторые виды белков, изучение которых до сих пор продолжается.
Необходимость проведения теста на наличие мутаций перед применением препаратов указана в руководствах по применению этих лекарственных препаратов. Но тест статуса онкогена KRAS пока не указан в руководствах к препаратам Тарцева и Иресса, связь резистентности НМРЛ с мутациями KRAS к этим препаратам была выявлена при исследованиях на пациентах азиатских и европейских этнических групп, включая больных с мутациями одновременно РЭФР и KRAS.
Кому рекомендуется делать тест KRAS?
Тест на мутации онкогена KRAS необходим больным КРР для оценки возможности лечения препаратами Вектибикс или Эрбитукс. Также рекомендуется пройти тест KRAS больным КРР для оценки возможности терапии лекарственными препаратами Тарцева или Иресса.
Наличие активирующих мутаций онкогена KRAS в опухолях является главным противопоказанием к применению лекарственным препаратов - ингибиторов РЭФР (Тарцева, Эрбитукса, Иресса, Вектибикса).
Любая из шести мутаций двенадцатого кодона (gly12asp, gly12ala, gly12arg, gly12val, gly12ser, gly12cys) и одна мутация тринадцатого кодона (gly13asp) коррелируют с резистентностью опухолей РТПК и НМРЛ к лечению препаратами Тарцева, Эрбитукса, Иресса или Вектибикса.
Клинические исследования значения мутаций KRAS или зачем проверяются молекулярно-генетические изменения в генах KRAS?
Согласно проведенным исследованиям было установлено, что существует большая разница в реакции на лечение на рецепторы РЭФР между опухолями без мутации и опухолями, клетки которых несут мутации в KRAS. Проверка наличия мутации в онкогене KRAS помогает в решении, есть ли место для лекарственных препаратов, ингибиторов РЭФР, в случаях колоректального рака, после неудачи химиотерапии. Так. Например, опубликованное в 2008 году исследование, в журнале под названием Clinical Journal of Oncology, еще раз доказало, что применение препарата Эрбитукс, при наличии мутации в онкогене KRAS, является неэффективным. Это является прогностическим показателем. В то же время лечение будет эффективным для больных колоректальным раком, с мутацией в РЭФР, но без мутации в онкогене KRAS.
Проведенные исследования
Исследование №1
В настоящее время пациенты с колоректальным раком сразу после постановки врачом диагноза могут пройти специальный тест, определяющий статус онкогена KRAS. Это позволяет врачам выбрать оптимальное лечение и улучшить отдаленные результаты. У больных с диким типом онкогена KRAS при применении анти-РЭФР терапии может наблюдаться в первой линии лечения частота ответа 59% и снижение прогрессирования на 40%.
Такой факт имеет важное значение, так как во многих исследованиях была продемонстрирована целесообразность достижения высочайших показателей частоты ответа, потому как последняя коррелирует с большой вероятностью излечения и частотой резекции, в частности:
В рандомизированном исследовании третьей фазы медиана ОВ в популяции больных, имеющих дикий тип онкогена KRAS и получающих Эрбитукс, а также химиотерапию FOLFIRI, составила 23 месяца по сравнению с 20 месяцев у пациентов, получающих только химиотерапию (p=0,0094; КР=0,796). Также в исследовании CRYSTAL было доказано снижение риска прогрессирования этого заболевания на 30 % при добавлении Эрбитукса к химиотерапии (p=0,0012; КР=0,696).
Наблюдалось существенное увеличение ЧО до 58 % в группе, где применялась комбинация Эрбитукс и химиотерапии по сравнению с 40 % при использовании лишь химиотерапии (p<0,0001).
В рандомизированном исследовании второй фазы медиана ОВ составила 22 месяцев у пациентов, имеющих дикий тип онкогена KRAS и получающих лечение Эрбитуксом в комбинации с химиотерапией, по сравнению с 18 месяцами у пациентов, получающих только химиотерапию (p=0,3854; КР=0,855).
Кроме этого, при данном исследовании врачи наблюдали снижение риска прогрессирования КРР на 43,4% (p=0,0064;КР=0,567) у пациентов, получающих Эрбитукс вместе с химиотерапией, по сравнению с самой только химиотерапией в популяции пациентов, имеющих дикий тип онкогена KRAS.
Также в исследовании было продемонстрировано увеличение частоты ответа на 67 % в группе применения препарата Эрбитукс и химиотерапии FOLFOX по сравнению с самой только химиотерапией у пациентов, имеющих дикий тип онкогена KRAS (ЧО – 57 % в противовес 34 %, p=0,0027).
Все эти данные говорят о высокой эффективности Эрбитукса при добавлении его к химиотерапии в первой линии лечения КРР у пациентов, имеющих дикий тип онкогена KRAS, по сравнению с самой только химиотерапией.
Исследование № 2
Мутации онкоогена KRAS выявляют в 40 % случаев КРР. На сегодняшний день уже было описано свыше трех тысяч точечных мутаций гена в опухолевых клетках. Приблизительно 17% и 82% всех мутаций онкогена KRAS обнаруживают в кодонах 13 и 12 соответственно. Только 3% пациентов с наличием мутации онкогена KRAS в клетках опухоли отвечают на лечение анти-РЭФР, в то время как у больных, опухоли которых экспрессируют дикий тип онкогена, такой показатель достигает 33%. Поэтому определение статуса онкогена KRAS является ключевым моментом в прогнозе ответа на терапию цетуксимабом и панитумумабом. Врачи рекомендуют использование анти-РЭФР для лечения КРР исключительно пациентам без мутации онкогена KRAS.
Цель исследования - определение частоты, а также спектра мутаций онкогена KRAS у людей, больных КРР.
Объектом исследования были сто тридцать девять образцов опухолевой ткани больных КРР. В данное исследование, для исключения ошибки отбора, включили всех пациентов, направленных на тестирование статуса гена KRAS. Среди пациентов было 104 женщины и 35 мужчин, средний возраст которых составил 63 года.
Врачи исследовали опухолевую ткань, которая была получена от пациентов при проведении хирургического вмешательства, фиксированную формалином и закрытую парафиновыми блоками. Затем парафиновые блоки нарезали с целью получения 3–6-серийных срезов толщиной 7 мкм и далее фиксировали на стеклах. Для патогистологической оценки и выявления зон локализации клеток опухоли один из срезов был окрашен гематоксилин-эозином. После депарафинизации в ксилоле осуществляли макро- или микродиссекцию 2–4-х срезов ткани с целью получения суспензии клеток, которая содержит не менее 72% опухолевых. ДНК выделяли при помощи наборов Nucleospin Tissue DNA Mini-Kit и QIAamp DNA minikit в строгом соответствии с рекомендациями данных немецких производителей. Статус онкогена KRAS изучали амплификацией мутантной последовательности ДНК вместе с супрессором нормальной аллели с маркировкой продукта цепной полимеразной реакции биотином c дальнейшей избирательной гибридизацией биотинилированного продукта на пробы стрип-теста (ViennaLab, KRAS StripAssay, Австрия) в строгом соответствии с рекомендациями производителя. Данный метод позволил определить мутации, которые локализированы в 12-м (р.Gly12Arg, р.Gly12Val, р.Gly12Leu, р.Gly12Ile, р.Gly12Asp, р.Gly12Ala, р.Gly12Cys, р.Gly12Ser) и 13-м (р.Gly13Cys, р.Gly13Asp) кодонах второго экзона гена KRAS.
При помощи программного пакета под названием Statistica 5.5 (США) были проведены статистические расчеты. Данные оценивали с применением критерия Фишера в 2-х стороннем варианте. При р<0,05 разница между показателями оценивалась как значимая.
Результаты
Из ста тридцати девяти образцов опухоли статус онкогена KRAS (мутационный) удалось выявить в ста тридцати одном случае. В восьми случаях трехкратные попытки амплификации ДНК были безуспешны, что обусловлено с наибольшей вероятностью химической модификацией и деградацией ДНК опухолевых клеток во время гистологической проводки. Из сто тридцать одного случая, в которых выявление мутационного статуса онкогена KRAS оказалось возможным, наличие мутаций в 13-м и 12-м кодонах онкогена определено в 56 (примерно 43 %). В спектре уже определенных мутаций самой частой (36%, 20 из 56 пациентов с мутацией) оказалась замена в 12-м кодоне (р.Gly12Asp) глицина на аспартат. Затем, по частоте представления, расположились мутации таким образом: р.Gly12Val - 30,5% (17 из 56 пациентов с мутацией), р.Gly13Asp - 10,6% (6 из 56 пациентов), р.Gly12Ser — 8,8% (5 из 56 пациентов), р.Gly12Cys - 7,2% (4 из 56 пациентов), р.Gly12Ala - 5,3% (3 из 56 пациентов), р.Gly12Arg - 1,8% (1 из 56 пациентов). Также стоит отметить, что не были представлены (ни в одном из случаев) две или более мутаций одновременно.
Обсуждение
Таким образом, мутационный статус онкогена KRAS был определен у 139 больных КРР. Так как по данным опубликованных работ, 98–99% мутаций онкогена KRAS приходится на 12-й и 13-й кодоны, и только 2% мутаций - в 146-м и 61-м кодонах, мы ограничились исследованием самых частых аномалий. Мутации онкогена KRAS были обнаружены в образцах у 56 из 131 больного (42,7%). Полученные данные полностью соответствуют другим результатам генотипирования, согласно которым частота мутаций онкогена KRAS находится в диапазоне 36–44%.
По результатам проведенного исследования лидирующие позиции в спектре мутаций занимают р.Gly12Asp, р.Gly12Val, р.Gly13Asp. Хотя соотношения частот мутаций, по данным разных авторов, немного отличаются между собой, хотя особо значимых различий как по спектру между данными, так и по их частоте нет.
В исследовании была выявлена связь между частотой мутаций в гене KRAS и полом больных КРР. Оказалось, что среди женщин уровень распространенности мутации онкогена KRAS выше, чем среди больных мужского пола (49%, 47 из 98 пациентов против 27 %, 10 из 33 пациентов соответственно). Все полученные результаты были полностью сопоставимы с данными Hong Shen исследования и его соавторов, которые определили мутации онкогена KRAS у женщин и мужчин, больных КРР, на уровне 44,6 и 28,3%. Однако, так как в крупном исследовании, которое включало 2721 пациента, не было установлено зависимости пола от частоты мутации онкогена, выявленные тенденции нужно проверить на большем объеме выборки.
Полученные результаты исследования говорят о распространенности мутаций KRAS при КРР и подтверждают, что их спектр и частота в популяции больных КРР нашей страны никоим образом не отличаются от таковых среди больных этим заболеванием Китая и Западной Европы. Таки образом, определение статуса онкогена KRAS является ключевым моментом в прогнозировании ответа на терапию анти-РЭФР.
Выводы
- Данные о спектре и частоте мутаций онкогена KRAS у больных КРР в нашей стране не отличаются от других результатов генотипирования, полученных при исследованиях других зарубежных авторов.
- Мутации онкогена KRAS в нашей стране встречаются реже у мужчин, чем у женщин.
- В связи с непригодностью парафиновых блоков для исследований мутационного статуса онкогена рекомендовано соблюдать условия (при гистологической проводке образцов), дающие возможность проведения генетических тестов.
- Рекомендовано использование препаратов-ингибиторов РЭФР для лечения опухолей, которые содержащих онкоген KRAS дикого типа. Их хорошая переносимость, а также возможность контроля их побочных эффектов (кожных реакций и диареи) доказана в клинических исследованиях.
Статьи по теме
Как не пропустить у себя рак кишечника.
Рак кишечника – один из самых трудно диагностируемых раков, особенно на ранних стадиях. И обычно к врачу обращаются пациенты уже на 3-4 стадии, зачастую неоперабельные. Если опухоль метастазировала, то прогноз у такого пациента крайне неблагоприятный. А ведь всего этого можно избежать, если бы человек обратился на несколько месяцев раньше.
Весь кишечник можно разделить на тонкий и толстый. В тонком кишечнике рака практически не бывает. А вот в толстой, а особенно в прямой кишке рак – частый гость.
При обнаружении у себя следующих симптомов необходимо срочно обратиться к врачу:
- Боли внизу живота. Прежде всего, их стоит дифференцировать от гинекологических заболеваний. Но если боли периодические, то следует обратиться к врачу.
- Разнообразные кишечные расстройства – запоры, понос, урчание, вздутие живота, метеоризм. Не спешите пить многочисленные лекарства, улучшающие перистальтику. Эти симптомы – самые первые при раке кишечнике. И многие люди не придают им значения.
- Кровотечение при акте дефекации. Это может быть совсем небольшое количество крови, могут быть просто мазки. Но это уже тревожный признак, и не обязательно, что геморроя. Если вы сами заботитесь о своем здоровье, то после 40 лет хотя бы раз в год будете сдавать копеечный анализ на скрытую кровь в кале. Это поможет выявить как рак, так и многие другие заболевания кишечника на ранних стадиях. Например, в Австралии анализ на скрытую кровь является скрининговым методом, как у нас ежегодная флюорография. И результат налицо – в Австралии один из самых низких показателей в мире по впервые выявленному раку на поздних стадиях. Задумайтесь!
- Патологические выделения при акте дефекации – слизь, гной, кровь.
- Потеря аппетита, снижение массы тела, отрыжка, чувство тяжести и другие признаки дискомфорта после приема пищи. Обычно, все это указывает на гастрит и язвенную болезнь желудка. Но, зачастую, потеря аппетита подсознательная, т.к. через несколько часов после еды человек начинает испытывать сильную боль в животе.
Как видно, все симптомы рака кишечника неспецифичны и носят общий характер большинства кишечных заболеваний. Но если вовремя придать значение этим «тихим» признакам, то можно не только вылечить другие заболевания, но и предотвратить рак, ведь большинство подобных кишечных патологий могут в будущем переродиться в опухоль.
Клетки кровеносных сосудов приводят клетки колоректального рака в более опасное состояние
Ученые UT MD Anderson обнаружили, что опухолевые эндотелиальные клетки микрососудов обращают раковые клетки в раковые стволовые клетки
ХЬЮСТОН – кровеносные сосуды, поставляющие кислород и питательные вещества к опухолям могут также доставлять что-то еще – сигнал, который укрепляет близлежащие раковые клетки, делая их более стойкими к химеотерапии, способными распространяться к другим органам и более летальными. Сообщение об этом распространил Центр раковых исследований MD Anderson Техасского университета.
Работая над клеточными линиями колоректального рака человека и образцами опухолей, наряду с мышиными аналогами, исследователи обнаружили, что эндотелиальные клетки, которые располагаются вдоль внутренней части кровеносных сосудов, могут вызвать изменения в раковых клетках, даже не входя в контакт с ними.
Эти сигналы эндотелиальных клеток заставляют клетки колоректального рака приобретать свойства раковых стволовых клеток, говорит Ли М. Эллис M. Ellis, M.D., профессор MD Anderson Отделения онкологической хирургии и биологии рака, ведущий автор работы.
«Раковые стволовые клетки инициируют и поддерживают рост опухоли, поддерживают метастазы и сопротивляемость химеотерапии, а также имеют массу других свойств», - говорит Эллис. «Мы идентифицировали новый способ, при котором элементы микроокружения опухоли, в данном случае эндотелиальные клетки, стимулируют превращение злокачественных клеток в стволовые раковые клетки».
Группа установила, что в кровеносных сосудах происходит неизвестный ранее процесс активации молекулярного прохода рецепторного белка Notch в клетках колоректального рака, что инициирует эту конверсию.
Возможности лекарственных средств, подавляющих рецепторный белок Notch
Notch - это рецепторный белок, располагающийся на поверхности клетки, который, как считалось, активировался только лигандами белков на поверхности других клеток. Требовался контакт между клетками. Notch важен для многих клеточных функций, включая формирование новых кровеносных сосудов, но он часто становится непрочным при раковых заболеваниях.
"Наши разработки предполагают, что ингибиторы Notch находятся в стадии разработки, а сейчас, при клинических испытаниях, могут быть способны воздействовать на опухолевые клетки напрямую, через их сосудистую систему или обоими способами", - говорит Эллис.
Колоректальный рак является вторым по смертности раковым заболеванием в Соединенных Штатах – ежегодно случается 50 000 летальных исходов, вызываемых неизлечимой метастатической болезнью. Микроокружение опухоли, которое включает кровеносные сосуды, поддерживающую ткань и такие состояния как гипоксия или нехватка кислорода являются благодатной почвой, на которой появляются зачатки метастаз.
Джиа Лю (Jia Lu) первый в списке авторов работы, и его коллеги сосредоточились на возможном влиянии эндотелиальных клеток на развитие стволовых раковых клеток. В серии экспериментов, проведенной группой исследователей в MD Anderson и других институтах, исследователи систематически подтверждали связь между эндотелиальными клетками и стволовыми клетками колоректального рака.
- Выращивание клеток колоректального рака человека совместно с эндотелиальными клетками увеличило количество раковых клеток, в которых наблюдается деятельность двух генов-маркеров раковых стволовых клеток, деятельность CD133 и ALDH.
- Рост раковых клеток среди эндотелиальных клеток увеличивает количество клеток с геном CD133 в семь раз, клеток с геном ALDH в 16 раз и становится причиной шестикратного возрастания возможности формирования сферы, другого отличительного признака стволовых раковых клеток
- В эксперименте с использованием мышей помещение колоректальных клеток в среду, насыщенную эндотелиальными клетками, привело к ускорению формирования опухоли и более быстрому ее росту, по сравнению с ростом клеток в контрольной среде.
- Колоректальные раковые клетки в кондиционированной среде с эндотелиальными клетками образовали больше метастазов, чем колоректальные раковые клетки в контрольной кондиционированной среде. В одном из исследований метастазов печени, 9 из 10 мышей с введенными им изучаемыми раковыми клетками получили метастазы печени, по сравнению только с 3 из 10 из контрольной группы.
- Колоректальные раковые клетки, выращиваемые в среде, кондиционированной эндотелиальными клетками, выживали дольше при лечении двумя видами химеотерапии.
- При анализе присутствия молекулярных цепей, вовлеченных в развитие раковых стволовых клеток, было определено, что в изучаемых колоректальных раковых клетках был активизирован только проход для Notch.
- Notch активизируется в колоректальных раковых клетках, смежных с эндотелиальными клетками в опухолях человека.
- Обнаружив, что эндотелиальные клетки выделяют растворимые протеины, группа нашла растворимую форму протеина Jagged-1 активированного Notch, стимулирующую преобразование раковых стволовых клеток. Протеин Jagged-1 был ранее известен как активирующий Notch лиганд, прикрепленный к поверхности другой клетки.
- Затем они установили, что протеаза ADAM17 отсекает часть Jagged-1 и производит его растворимую форму.
- Клеточная линия и эксперименты на мышах показали, что блокирование производства ADAM17 с незначительным вмешательством RNA или с ингибитором протеазы блокирует образование колоректальных раковых стволовых клеток.
"Важна воспроизводимость результатов. В этих экспериментах мы использовали множественные эндотелиальные клеточные линии и клеточные линии колоректальных раковых клеток и обнаруживали то же самое снова и снова», - говорит Эллис.
Способ распространения клетками сигналов, вовлеченных в эту цепь событий, - это паракринное распространение сигналов, взаимодействие между двумя различными видами клеток через растворимые медиаторы, а не через прямой контакт. Тем не менее, недавно Шахин Рафии (Shahin Rafii), M.D., из медицинского колледжа Weill Cornell назвал передачу сигналов между эндотелиальными клетками и другими целевыми клетками «ангиокриновыми сигналами» «angiocrine signaling». Эту терминологию поддерживает и Эллис.
Для лечения метастатического рака прямой кишки применяется шесть видов лекарственных средств, включая те, которые воздействуют на кровеносные сосуды, поддерживающие опухоли. Но значительных улучшений у пациентов не наблюдалось, с общей медианой выживаемости – менее, чем два года. При условии проведения дополнительных исследований, открытия группы могут привести к более совершенной терапии метастатического колоректального рака. Будущие исследования будут сфокусированы на других факторах выделений эндотелиальных клеток, которые вызывают агрессию раковых клеток. «Ясно, что эндотелиальные клетки – это более чем просто канал для доставки крови. На самом деле, при проведении предварительных экспериментов выяснилось, что эндотелиальные клетки выделяют больше белков, чем раковые клетки. Эта работа, конечно, требует подтверждения».
Три подвида молекулярного колоректального рака в новой диагностической классификационной системе
Международная группа исследователей провела независимый расширенный геномный анализ колоректального рака, чтобы попытаться классифицировать колоректальные опухоли на молекулярном уровне. В отличие от рака груди, в настоящее время нет молекулярной классификации колоректальных видов рака, которая позволила бы облегчить диагностику, прогнозирование и выбор методов лечения. Группа предложила выделить три выраженных молекулярных подвида, потенциально клинически релевантные и различающиеся по своей биологии и клиническим исходам. Эти результаты были представлены в Американском обществе клинической онкологии (ASCO) на симпозиуме по гастроинтестинальным видам рака, проходившем с 24 по 26 января 2013 года в Сан-Франциско.
По мнению Джозефа Табернеро (Josep Tabernero), руководителя клинических исследований в институте онкологии Vall d’Hebron в Барселоне, который выступил на конференции ASCO GI, было выявлено три выраженных подтипа. Это может помочь разработке молекулярных тестов для идентификации пациентов, у которых имеется повышенный риск развития колоректального рака, и предсказывания того, каким пациентам могут помочь химиотерапия и направленно действующие препараты.
Группа, в которую входили Табернеро и Доктор Рене Бернардс (René Bernards), руководитель отделения молекулярного канцерогенеза Нидерландского института рака в Амстердаме, сделала геномный анализ 188 образцов экспрессии гена в колоректальных видах рака. Были проанализированы пробы с I по IV стадию. Молекулярная классификация подвидов, которая была введена после анализа этих проб, была затем использована в подтверждающем наборе данных полученных из 543 проб, взятых у пациентов с I и IV фазой колоректального рака. Подвиды были определены согласно клинической информации, статусу биомолекулярных маркеров и результатам химиотерапии каждого пациента.
Три колоректальных подвида
В подтверждающем наборе данных 21,5% проб были отнесены к подвиду А, 62% к подвиду В, а 16,5% к подвиду С. Основными характеристиками, которые отличались у этих подтипов, были транзиция из эпителия в мезенхиму (маркер, связанный с наиболее агрессивными опухолями); дефектами в системе генов, которые ответственны за исправление ошибок репликации ДНК, которые ассоциируются с высоким уровнем генетических мутаций; уровень пролиферации клеток.
Согласно результатам, подтипы А и В имеют лучшие клинические исходы по сравнению с пациентами подтипа С. Пациенты с подтипами А и В могут получить пользу от адъювантной химиотерапии.
Подтипы А и С имеют наибольшую частоту мутаций из-за недостатка исправлений ошибок спаривания. Все подтипы включают опухоли с BRAF мутациями (39% подтипа А, 2% подтипа В и 16% подтипа С). Подтипы А и С имеют бо́льшую частоту мутаций генов P13KCA и KRA, по сравнению с подтипом В.
Так как не существует одной или двух мутаций уникальных для каждого подтипа, Бернардс отмечает, что единственным способом недвусмысленного причисления больных к любому из трех подтипов является анализ экспрессии генов. Agendia, компания молекулярной диагностики рака со штаб-квартирой в Амстердаме, и лабораториями, работающими в Ирвине (Калифорния), разработали генетический профиль для идентификации любого из трех подтипов колоректального рака. «Мы опубликуем сведения об отличительных признаках этих генов в ближайшем будущем», - говорит Бернардс.
Выводы и последующие шаги
Бернардс считает, что более экстенсивное генетическое профилирование необходимо для разделения пациентов по различным типам опухолей, отмечая, что выводом из этого исследования можно сделать то, что пациенты не могут быть подразделены только по видам мутаций. «Это разделение на подтипы идентифицирует подгруппы, имеющие различную биологию, так же как базальный и люминальный раки груди по разному реагируют на химиотерапию и имеют разные прогнозы течения», - говорит Бернардс. Авторы исследования планируют изучить эти три подтипа как часть клинических испытаний в сотрудничестве с фармацевтическими компаниями.
Комбинированная терапия при раке толстой кишки
Исследователи сообщают, что комбинация терапии первой линии посредством бевацизумаба и капецитабина может быть оптимальным лечением первой линии метастатического колоректального рака ранее не леченных престарелых пациентов.
Проспективное испытание III фазы, сравнивающее комбинированную терапию с лечением только капецитабином как лечение первой линии метастатического колоректального рака, показало, что у пациентов в возрасте 70 лет и старше значительно увеличилась выживаемость без прогрессирования, когда их лечили и капецитабином и бевацизумабом. Об этом сообщил Дэйвид Каннингем, врач больницы Royal Marsden в Лондоне, на устной сессии во время симпозиума по гастроинтестинальным видам рака.
Комбинированная терапия улучшила общую частоту ответов (19.3% против 10%, P=0.042), а общая медиана выживаемости становится длиннее у пациентов, получавших оба препарата (20.7 месяцев против 16.8), хотя более долгая выживаемость не намного выше, чем при общей выживаемости после монотерапии (P=0.182), как отмечает Каннингем.
Во время презентации Каннингем отметил, что, несмотря на средний возраст больных метастатическим колоректальным раком, «престарелые пациенты в основном недополучают лечение» и исследование направлено на поиск оптимального подхода к лечению.
- Фаза III клинических испытаний AVEX проверила безопасность и силу воздействия бевацизумаба и капецитабина на не леченных ранее больных колоректальным раком в возрасте от 70 лет и выше в 10 странах.
- Каннингем отметил, что испытание стало первым исследованием III фазы с проспективным оцениванием использования биопрепаратов у престарелых больных колоректальным раком.
- Участники эксперимента методом случайной выборки были разделены на две равные группы: 140 человек получали 7.5 мг/кг бевацизумаба и 1000 мг/м2 капецитабина, в другой группе получали только 1000 мг/м2 капецитабина.
- Ожидаемые результаты включали выживаемость без прогрессирования, общую выживаемость, общую частоту ответов и безопасность. По словам автора, расследование было нацелено на определение разницы между выживаемостью в группах без прогрессирования, но не на общую выживаемость.
- Перед началом эксперимента средний возраст пациентов был 76 лет, а по шкале ECOG состояние здоровья оценивалось значениями 0 или 1.
- Комбинированная терапия ассоциировалась со значительно увеличенным периодом выживаемости без прогрессирования, значительно улучшенной общей частотой ответа и тенденцией к более длительной общей выживаемости по сравнению с монотерапией с использованием капецитабина.
- Частота контроля заболевания у пациентов стояла на первом месте в группе с комбинированным лечением по сравнению с монотерапией (74.3% против 57.9%, P=0.005).
- Частота любых побочных явлений была примерно одинаковой (95.5% при комбинированном лечении против 95.6% с использованием монотерапии). Побочные явления 3 или 4 степени были более обычными в группе с комбинированной терапией, чем в группе с монотерапией (59% против 44.1%, соответственно). С другой стороны побочные явления 5 степени встречались более часто у тех, кого лечили только капецитабином (8.2% против 11.8%).
Каннингем отметил, что профиль побочных явлений был ожидаем в среде пациентов, добавив, что «профиль безопасности был сопоставим с ранее полученными данными лечения метастатического колоректального рака бевацизумабом».
"В основном лечение переносилось хорошо, а профиль безопасности был сопоставим с ранее полученными данными для бевацизумаба и капецитабина», - заключил Каннингем на устной презентации.
Биомаркеры преимуществ терапии с использованием цетуксимаба при метастатическом колоректальном раке: взаимодействие EGFR лиганды expression c генотипами RAS/RAF, PIK3CA.
На более чем половину больных с KRAS – развитым колоректальным раком дикого типа (CRC) не действуют анти-EGFR моноклональные антитела.
Была изучена EGFR экспрессия информационной РНК (иРНК) и мутации RAS, RAF, PIK3CA, чтобы идентифицировать дополнительные маркеры эффективности цетуксимаба.
Методы: ранее генотипированные (KRAS, NRAS, BRAF, PIK3CA мутации) зафиксированные формалином парафинированные биопсии опухолей, 226 больных колоректальным раком, принимавших цетуксимаб (с первой по третью линии терапии), были проверены на экспрессию иРНК рецептора эпидермального фактора роста (EGFR) и эпидермальный фактор роста лиганд. Трансформирующий фактор роста-a (TGFA), Амфирегулин (AREG) и Эпирегулин (EREG) с количественной ПЦР в реальном времени.
Мутации были обнаружены в 72 (31.9%) опухолей у KRAS, в 6 (2.65%) у BRAF, 7 (3.1%) в NRAS и 37 (16.4%) в PIK3CA.
Результаты:Только мутации PIK3CA иногда сосуществуют с другими генными мутациями. При однофакторном анализе прогностическое значение выживаемости (от появления метастазов до смерти) наблюдались при мутациях BRAF (отношении рисков HR 8.1, 95% CI 3.4-19) кодон 12-только KRAS мутаций (HR 1.62, 95% CI 1.1-2.4), высокой экспрессии Амфирегулина иРНК только при мутации дикого типа KRAS при колоректальном раке (HR 0.47, 95% CI 0.3-0.7) и высокой экспрессии Эпирегулина иРНК вне зависимости от статуса мутаций KRAS (HR 0.45, 95% CI 0.28-0.7).
Экспрессия эпирегулина опухолевой иРНК в значительной степени ассоциировалась с возрастанием в 2, 26 раза вероятности объективного ответа на терапию с применением цетуксимаба (RECIST 1.1). При многовариационном анализе благоприятными предсказательными факторами были высокий уровень Эпирегулина иРНК в опухолях дикого типа с KRAS, высокий эпирегулин иРНК, низкий уровень рецептора эфрин A2 в иРНК.
Больные, принимавшие цетуксимаб с низким амфирегулином в KRAS при колоректальном раке дикого типа, wild type CRC fared very poorly, их выживаемость была такой же, как при раке с мутациями KRAS. Больные с кодон 13 мутациями KRAS или другими 12 некодоновыми мутациями имели среднюю выживаемость (30 месяцев, 95% CI 20--35) так же, как и пациенты с KRAS дикого типа (средняя выживаемость 29 месяцев, 95% CI 25--35), По сравнению с другими, пациенты с кодон 12 мутациями KRAS получили худший результат (средняя выживаемость 19 месяцев, 95% CI 15--26).
Заключение: мутация BRAF и кодон 12 KRAS мутации предполагают неблагоприятный исход для пациентов, принимающих цетуксимаб.
Амфирегулин (AREG) иРНК отражает рецепторы эпидермального фактора роста EGFR иРНК при опухолях дикого типа с мутациями KRAS, обусловливая эффективность цетуксимаба при высоком уровне (AREG) и неэффективность при низком уровне. Эпирегулин (EREG) может играть прогностическую роль независимо от мутации KRAS.
Могут ли новые лекарственные средства помочь больным колоректальным раком?
Базирующаяся в Калгари Calgary-based Онколитическая Биотехническая компания (Oncolytics Biotech Inc.) сообщила об открытии новых лекарственных средств для борьбы с колоректальным раком в Американском обществе клинической онкологии на симпозиуме по гастроинтестинальным видам рака, который был недавно проведен в Сан-Франциско.
Компания Oncolytics представила постер с результатами исследования 1 фазы больных колоректальным раком. При проведении исследования Реолизин, биологический препарат, разработанный Oncolytics, был назначен (наряду со стандартным режимом химеотерапии (FOLFIRI), состоящего из фолиниевой кислоты, флуороурацила и иринотекана) 18 больным колоректальным раком.
Основной целью было определение дозолимитирующей токсичности для определения максимальной допустимой дозы и фармакокинетики; вторичными ожидаемыми результатами были противоопухолевая активность, частота ответа, выживание без прогрессии и общая выживаемость. Было обнаружено, что сочетание Реолизина и FOLFIRI безопасно, хорошо переносимо и позволило контролировать течение болезни у большинства пациентов. Исследователи были вдохновлены результатами деятельности и испытанием на безопасность и планируют более глубокое изучение.
Результаты стали воодушевляющей новостью для тех, у кого был диагностирован колоректальный рак: согласно исследованиям национального института рака США, более чем у 140 000 американцев был установлен диагноз ракового заболевания в 2012 году, в то время как в этом же году умерло 52 000 человек. По всему миру диагноз колоректальный рак ставится более чем одному миллиону человек, около полумиллиона из них умирает.
Вызываемый неконтролируемым ростом клеток в прямой или толстой кишках, колоректальный рак часто излечим, если опухоль находится в указанных границах, но прогноз становится намного менее утешительным, если она распространилась. В этом случае придется прибегнуть к хирургическому вмешательству, химеотерапии и облучению со всеми вытекающими из этих процедур последствиями. Например, в то время как химеотерапия может уменьшить опухоль, она часто вырастает снова и перестает поддаваться лечению.
Подход компании Oncolytics к лечению основывается на онколитической виротерапии. При этом методе, вирусы внедряются внутрь опухоли, размножаются и постепенно разрушают раковые клетки; вирус направлен на воздействие на раковые клетки и не затрагивает здоровые ткани. Oncolytics получила Релизин из встречающегося в природе реовируса. Этот вирус показал впечатляющие результаты при клинических испытаниях, но особенно они были хороши при сочетании с определенными видами химиотерапии. В доклинических исследованиях в широком разнообразии раковых клеточных линий ученые обнаружили, что при совместном использовании реовирусы и химиотерапия приводили к более эффективной синергидной и противораковой активности, чем когда препарат был использован отдельно.
Многие считают реовирус , из которого получают Реолизин, наиболее обещающей формой онколитического вируса. Этот вирус преимущественно распространяется в раковых клетках, что приводит к обычной мутации, известной как «активированная дорожка Раса»( “activated Ras pathway"). При этом нормальные клетки сохраняются. Это делает вирус избирательно направленным на опухоли, и при этом не возникает нужды в генетических манипуляциях.
Реовирус не ассоциируется ни с какой известной науке болезнью. Он распространяется в цитоплазме и поэтому не вторгается в клетки ДНК. Реовирусы широко распространены в природе и изолированы от сточных, речных и стоячих вод. Воздействие реовирусов на человека вполне обычно и не приносит ему вреда.

Может ли новая вакцина предупредить рак толстой кишки?
Для развития рака толстой кишки требуются годы, и он обычно начинается с полипа, который представляет собой доброкачественный, но патологический вырост в оболочке кишечника. Полипы, которые могут стать канцерогенными, называются аденомами, и обычно удаляются до развития рака.
“Это вакцина для профилактики рака толстой кишки укрепляет природный иммунный резерв пациента, который потенциально может привести к исключению предраковых поражений, из которых впоследствии развиваются опухоли», - говорит Оливера Финн (Olivera Finn), ведущий профессор и председатель департамента иммунологии Школы Медицины при Питтсбургском университете, разработавший эту вакцину.
“Это может избавить пациентов от рисков и неудобств периодических инвазивных профилактических осмотров, таких как колоноскопия, которая используется для отслеживания развития и удаления предраковых полипов».
Для развития рака толстой кишки требуются годы, и он обычно начинается с полипа, который представляет собой доброкачественный, но патологический вырост в оболочке кишечника. Полипы, которые могут стать канцерогенными, называются аденомами, и обычно удаляются до развития рака.
Результаты первых клинических испытаний на человеке опубликованы онлайн и в январском выпуске журнала «Исследования по предупреждению рака» CancerPreventionResearch. К исследованию привлекались люди с развитой аденомой, у которых был высокий риск дальнейшего развития колоректального рака.“От 30 до 40 процентов этих пациентов переживали рост нового полипа уже в течение трех лет», - отмечает Роберт Е. Шоэн (Robert E. Schoen), профессор медицины и эпидемиологии отделения гастроэнтерологии, гепатологии и питания и клинический руководитель исследования.
“В этом исследовании мы продемонстрировали возможность вакцины укрепить иммунитет. Будущие испытания требуются для оценки возможности вакцины снижать или предупреждать вероятность нового появления полипа и развития рака толстой кишки».
Вакцина направлена против патологического варианта самопроизвольно появляющегося клеточного протеина, называемого MUC1, который в избытке производится в аденомах и раковых опухолях. MUC1 также абнормально присутствует при раке поджелудочной железы, груди, легких и простаты и в будущем определяется у пациентов с предраковыми поражениями, приводящими к этим видам рака.
К настоящему времени не известно ни одной вакцины для профилактики рака, основанной на клеточных протеинах, производимых опухолями. Доклинические модели показывают, как вакцина работает, будучи направленной на клетки с патологией, в которых развивается рак.
Новая вакцина была испытана на 39 пациентах в возрасте от 40 до 70 лет не больных раком, но имеющих историю развитых аденом. Она произвела устойчивый защитный ответ у 17 пациентов или 44%. Исследователи считают, что отсутствие ответа у других 22 пациентов было, возможно, уже из-за высокого уровня клеток, которые угнетали способность иммунной системы противостоять раку.
“Таким образом, возможно, лучше было бы вакцинировать людей против рака толстой кишки даже еще на более ранней стадии или вакцинировать тех, у кого еще не угнетена иммунная система», - говорит Финн.
Пациенты при клинических испытаниях получали первоначальную дозу вакцины, а затем дополнительные инъекции через 2 и через 10 недель. В это же время для измерения иммунного ответа были взяты пробы крови, так же как и через 12 недель, 28 недель и через год. Инъекция бустер-дозы была сделана в течение года для подтверждения устойчивости иммунного ответа.
Вакцина была хорошо переносима и безопасна. Побочные действия включали покраснение кожи и дискомфорт в месте инъекции, а также симптомы похожие на грипп после первой инъекции. Безопасность вакцины и ее способность вызывать поддержку иммунного ответа, предполагает постановку дальнейших планов на более обширные испытания со случайной выборкой, которые помогут убедиться в эффективности предупреждения роста полипов.
Колоректальный рак стоит на третьем месте по смертности от злокачественных опухолей в США. Риск развития колоректального рака равен 1 к 20.
Исследования были профинансированы Национальным институтом раковых заболеваний и Национальным институтом здоровья.
Риску рака толстой кишки подвержено больше молодых людей, чем пожилых
Тайбэй, 2 февраля (CNA). По словам доктора Чен Шин-хсина (ChenChien-hsin), количество молодых людей в Тайване с колоректальными полипами, которые могут перейти в колоректальный рак, более чем в 6 раз превышает число пациентов среднего и пожилого возраста.
Среди 429 людей в возрасте 20-40 лет, получивших «чеки здоровья», спонсируемые правительством, у 111, или у 25.87 процента, были найдены колоректальные полипы, говорит Чен Шин-хсин, глава отделения колоректальной хирургии в госпитале Ван Фанг в Тайбэе. Он добавил, комментируя результаты проверки, организованной департаментом здравоохранения и организации противодействия раку «Formosa», находящейся в Тайбэе, что из 10,283 людей в возрастной группе от 50 до 70 лет, 410 человек или 3.99 процента, имеют колоректальные полипы.У 57% пациентов, получивших чек, были найдены полипы, в то время как у 4х был диагностирован рак толстой кишки в ранней стадии.
«Вероятность выживаемости при раке прямой кишки I степени равна 90%», - сказал Чен, добавив, что для успешного лечения важна ранняя диагностика.
Давая советы по диете, которая могла бы помочь предотвратить рак прямой кишки, Чен предложил есть сваренные на пару сбалансированные блюда с уменьшенным количеством специй, пищу с ингредиентами из цельного зерна и употреблять овощи с каждым приемом пищи. Он предупредил об опасности употребления слишком большого количество баранины и говядины. Чен также рекомендует физическую активность, по крайней мере, в течение 30 минут в день.
Рак это не только проблема здоровья, но и фактор влияния на общество и экономику, как заявляет Хванг-Пенг, член академии Синика (Academia Sinica), тайваньского топового исследовательского института. Хванг-Пенг также заявил, что к 2030 году у 81% жителей развивающихся стран может развиться рак, что может замедлить прогресс в развитии их экономики и социальных устоев. Более того, вопреки мнению, что в развитых странах имеется риск развития большинства злокачественных опухолей, Хванг-Пенг считает, что 55% раковых больных, все-таки, сосредоточено в развивающихся странах. В связи с заблуждением, что рак развивается только в пожилом возрасте, Хванг-Пенг отметил, что большинство случаев раковых заболеваний диагностируется в возрасте менее 65 лет.
Телефонные звонки и почтовые отправления могут значительно увеличить охват населения скринингом колоректального рака
Больные могут быть выявлены в три раза быстрее при помощи телефонной навигации и почтовых отправлений. Это обнаружили исследователи из онкологического центра Киммеля в унивеситете Джефферсона
ФИЛАДЕЛЬФИЯ – Почтовые отправления или телефонные звонки помогают пациентам пройти скрининг по поводу колоректального рака, что значительно повышает их шансы быть протестированными, говорится в исследовании, опубликованном в январском выпуске медицинского журнала «Cancer Epidemiology, Biomarkers and Prevention» (Эпидемиология рака, его биомаркеры и предупреждение») исследователями онкологического центра Киммеля в университете Джефферсона.
Группа исследователей, возглавляемых Рональдом Е. Миерсом Ronald E. Myers, Ph.D., профессором и директором отделения демографии департамента медицинской онкологии в университете Томаса Джефферсона, провели методом случайной выборки контролируемое испытание 945 человек в возрасте от 50 до 79 лет, чтобы проверить действие нового, основанного на преференциях навигационного вмешательства, как альтернативу обычным почтовым отправлениям.
Треть больных получила "tailored" телефонный звонок, побуждающий их провести предпочитаемое ими исследование (колоноскопию или домашний анализ кровяного стула), плюс почтовое отправление с предпочитаемой информацией; второй трети была прислана информация о колоноскопии и набор для проведения анализа кровяного стула; в то время как последняя треть не подверглась никакому вмешательству.
Вероятность того, что пациенты, которые получили телефонный звонок или почтовое отправление пройдут скрининг через 6 месяцев, была в 3 раза выше, чем у тех, кто не был подвергнут вмешательству. Тем не менее, не было значительной разницы между воздействием телефонного звонка вместе с почтовым отправлением с почтовым отправлением без звонка.
В то время как охват населения скринингом колоректального рака растет, он отстает от скрининга рака груди и шейки матки. Скрининг или ранняя диагностика рака толстой кишки и рака прямой кишки обещает значительное уменьшение смертности от этих заболеваний.
Колоректальный рак является третьим по смертности из всех видов рака среди населения США . Каждый год диагностируется более 140 000 новых случаев заболевания. Поздняя диагностика становится причиной большинства смертей от колоректального рака.
Исследование, которое было проведено между 2007 и 2011 годом, включило 10 врачебных практик первичной помощи, объединенных с системой здравоохранения Кристиана в штате Делавэр, которая использует вышеназванные методы.
Группа исследователей ведет поиск больных, у которых не было предварительного диагноза колоректальной неоплазии или воспалительных заболеваний кишечника, посетила одну из участвующих в программе в течение двух лет медицинских практик, отступив от инструкций Американского общества борьбы с раковыми заболеваниями.
В целях исследования 312 пациентов получили четко поставленную посредническую помощь, при которой их информировали и о колоноскопии и анализах кровяного стула. Затем посылалась информация о проведенной колоноскопии и о действительных анализах кровяного стула, основываясь на предпочтениях больных. Другая группа, состоявшая из 316 пациентов, получала информацию о колоноскопии и проведенных анализах кровяного стула. Оставшиеся 317 человек не получали телефонных звонков и информации об исследованиях по почте.
Через полгода 38% больных, получавших инструкции по телефону и 33% получавших по почте прошли скрининговые исследования. Из контрольной группы скрининг прошли только 12% больных."
Важная информация: Результаты анализа наличия в опухоли мутаций гена KRAS должны использоваться и интерпретироваться в сочетании с другими лабораторными и клиническими данными, при решении вопроса о назначениии пациету препаратов - ингибиторов рецепторов эпидермального ростового фактора.